马尔堡病毒与埃博拉病毒属于同“丝状病毒科”家族,它的发现早于埃博拉病毒。在1967年秋,西德马尔堡、法兰克福和南斯拉夫贝尔格莱德的几所医学实验室的工作人员中同时暴发了一种严重出血热,有31人发病,其中7人死亡,这些患者大都接触过一批从乌干达运来的非洲绿猴。科学家们对患者的血液和组织细胞进行了培养,分离出一种以前没有见到过的病毒。根据发病地点,将这种病毒命名为马尔堡病毒。
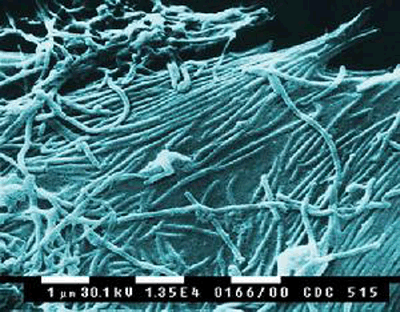 |
| 马尔堡病毒 |
这次爆发的来源经调查后,发现是来自非洲乌干达一种品种为 Cercopithecus aethiops 的猴子。德国的一家公司入口该批染有病毒的猴子,原意是用来研制小儿麻痹症的疫苗。1975年,一名从津巴布韦回到南非的人,感染了另外三名南非人。但该次小规模爆发只引致了一人死亡。之后1980年及1987年在肯尼亚亦有发现马尔堡出血病,但亦没有大规模爆发。之后最大的爆发发生在1998年至2000年的刚果民主共和国。
病毒基因组为单股负链RNA,长约19kb,编码7种病毒蛋白,包括N蛋白 (nucleoprotein,NP)、病毒蛋白35 (VP35)、病毒蛋白30 (VP30)、病毒蛋白24 (VP24)、糖蛋白4 (gp4)、RNA依赖的RNA聚合酶主要成分糖蛋白7 (gp7) 和次要成分病毒蛋白40 (VP40)。
病毒对热有中度抵抗力,56℃ 30分钟不能完全灭活,但60℃ 1小时感染性丧失。在室温及4℃存放35 天其感染性基本不变,-70℃可以长期保存。一定剂量的紫外线、γ射线、脂溶剂、β-丙内酯、次氯酸、酚类等均可灭活。本病毒可在多种细胞中培养,其中包括Vero细胞、Vero E6细胞和Hela细胞等。只发现一种血清型。
感染病毒的非人灵长类动物和病人是主要传染源。通常先由被感染的非人灵长类动物(如绿猴) 将病毒传染给人,然后再由病人传染给其他健康人。马尔堡病毒的传染性极强,症状越重的患者传染性越强,潜伏期患者的传染性弱。人不是病毒自然循环中的一部分,只是偶然被感染。本病毒在自然界中的储存宿主目前尚不清楚。
主要经密切接触传播,即接触病死动物和病人的尸体,以及感染动物和病人的血液、分泌物、排泄物、呕吐物等,经粘膜和破损的皮肤传播。在非洲疫区,因葬礼时接触病人尸体,曾多次发生本病暴发。通过密切接触也可以造成医院感染和实验室感染。此外,通过使用被污染的注射器等可造成医源性传播。有报道,病人在临床康复3月内,仍可在精液中检出马尔堡病毒,因此,存在性传播的可能性。通过含本病毒的气溶胶感染实验动物也有报道。
马尔堡病毒进入人体后,首先侵犯树突状细胞和巨噬细胞,尔后被带至区域淋巴结,在淋巴系统内播散,并通过血行感染肝、脾和其他组织。本病的发病机制主要包含以下两方面:
1. 病毒感染宿主细胞导致细胞的直接损伤:其机制是:病毒和细胞表面的凝集素结合,通过病毒蛋白的毒性作用导致细胞坏死。
2. 病毒和机体免疫系统相互作用导致细胞的间接损伤:其机制是:1 病毒由入侵部位扩散至各系统,从而抑制机体固有免疫应答,包括树突状细胞和巨噬细胞对1型干扰素的应答;2 由于病毒感染,树突状细胞对T细胞的活化受到部分抑制,从而影响体液免疫反应; 3 在整个感染过程中产生大量淋巴细胞凋亡,导致免疫抑制; 4 受感染的巨噬细胞产生各种介质,并通过各种途径导致严重病变,如细胞表面表达组织因子引发播散性血管内凝血;细胞因子和趋化因子的释放导致血管功能失调、低血压和多脏器功能衰竭等。
除横纹肌、肺和骨骼之外,几乎所有器官都可受损。其中肝、肾、淋巴组织的损害最为严重,脑、心、脾次之。肝、脾肿大,呈黑色。肝易破碎,切开时有多量血液流出,呈浅黄色。脾明显充血,滤泡消失,髓质软,呈粥糊样,在红色脾髓中可见大量巨噬细胞。红髓坏死并伴淋巴组织破坏,脾小体内淋巴细胞明显减少。肝细胞变性和坏死,常见透明变性。库普弗细胞 (枯否细胞) 肿胀凸出,充满细胞残渣和红细胞,窦状隙充满细胞碎屑。门静脉间隙内单核细胞蓄积,但在肝坏死达到高峰时,可见肝现时死亡率只有25%,但在发展中国家死亡率却可以高达100%。
一般相信病毒是透过与染病的人畜紧密接触,通过体液传播。日常接触相信不会传染。病患者危急时,体内的病毒传染力最强。部分非洲地区的殓葬风俗应该是导致疾病传播的原因之一。
不少研究机构正尝试研制对抗马尔堡药物及疫苗。2004年美国的研究人员已发现豚鼠注入不活跃的病毒后不会被感染。